Введение в обычные среды для культивирования микробов (I)
Культуральная среда представляет собой своего рода смешанную питательную матрицу, искусственно приготовленную из различных веществ в соответствии с потребностями роста различных микробов, которая используется для культивирования или разделения различных микроорганизмов.Следовательно, питательная матрица должна содержать питательные вещества (включая источник углерода, источник азота, энергию, неорганические соли, факторы роста) и воду, которые могут быть использованы микроорганизмами.В зависимости от вида микроорганизмов и цели эксперимента различают виды и способы приготовления питательных сред.
Некоторые распространенные питательные среды в эксперименте вводятся следующим образом:
Пищевая агаровая среда:
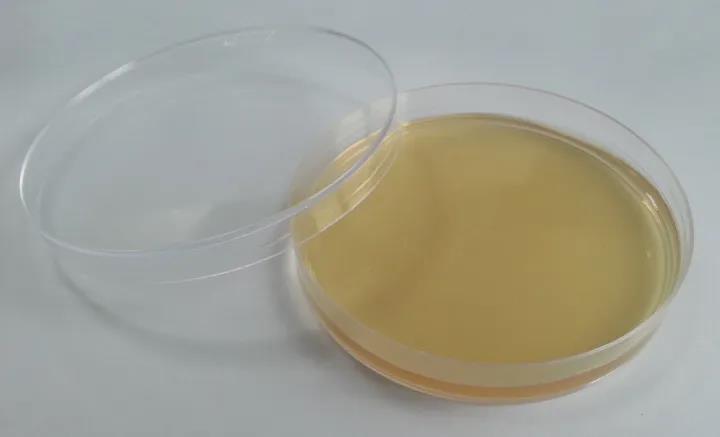
Питательная агаровая среда используется для размножения и культивирования обычных бактерий, для определения общего количества бактерий, сохранения видов бактерий и получения чистой культуры.Основные ингредиенты: экстракт говядины, дрожжевой экстракт, пептон, хлорид натрия, порошок агара, дистиллированная вода.Пептон и говяжий порошок являются источниками азота, витаминов, аминокислот и углерода, хлорид натрия может поддерживать сбалансированное осмотическое давление, а агар является коагулянтом культуральной среды.
Пищевой агар — это самый простой тип питательной среды, который содержит большую часть питательных веществ, необходимых для роста микроорганизмов.Пищевой агар можно использовать для рутинной бактериальной культуры.
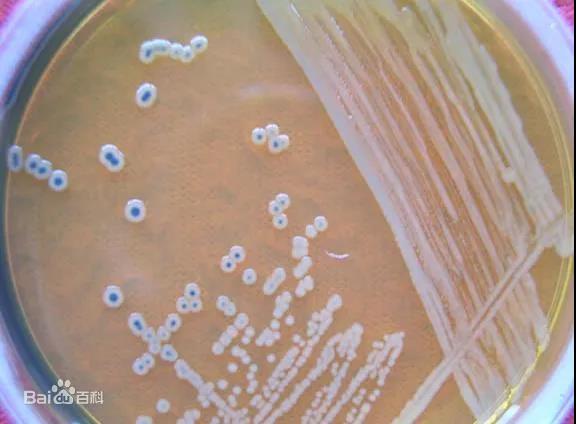
Среда с кровяным агаром:
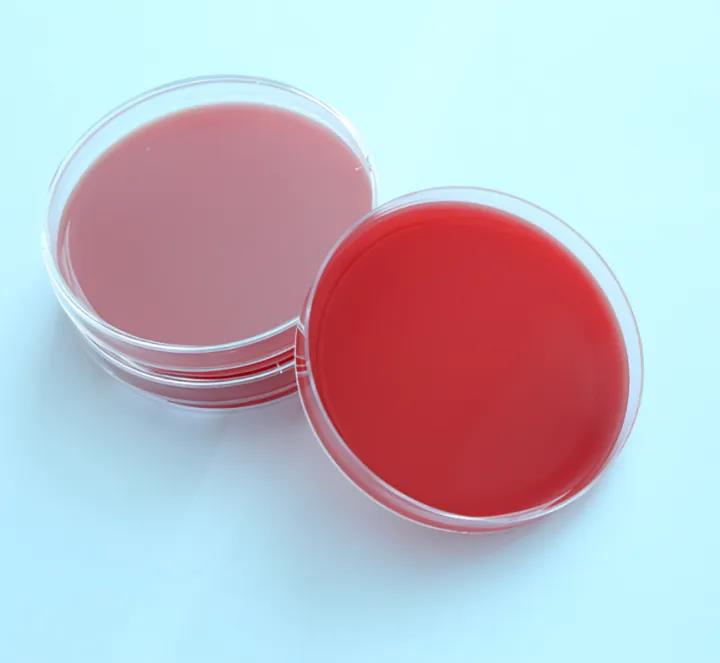
Среда с кровяным агаром представляет собой разновидность пептонной среды с экстрактом говядины, содержащей дефибринированную кровь животных (обычно кровь кролика или кровь овцы).Следовательно, в дополнение к различным питательным веществам, необходимым для культивирования бактерий, он также может содержать кофермент (например, фактор V), гем (фактор X) и другие специальные факторы роста.Поэтому среду для культивирования крови часто используют для культивирования, выделения и сохранения некоторых требовательных к питанию патогенных микроорганизмов.
Кроме того, кровяной агар обычно используется для теста на гемолиз.В процессе роста некоторые бактерии могут производить гемолизин, разрушающий и растворяющий эритроциты.Когда они растут на кровяной пластинке, вокруг колоний можно наблюдать прозрачные или полупрозрачные гемолитические кольца.Патогенность многих бактерий связана с гемолитическими характеристиками.Поскольку гемолизин, продуцируемый разными бактериями, различен, гемолитическая способность также различна, и явление гемолиза в пластинке крови также различно.Поэтому для выявления бактерий часто используют тест на гемолиз.
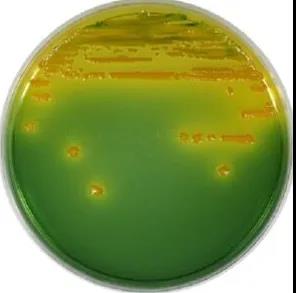
Среда TCBS:
TCBS представляет собой агаризованную среду с сахарозным агаром на основе тиосульфат-цитратной желчной соли.Для селективного выделения патогенных вибрионов.Пептон и дрожжевой экстракт используются в качестве основных питательных веществ в культуральной среде для обеспечения источника азота, источника углерода, витаминов и других факторов роста, необходимых для роста бактерий;Более высокая концентрация хлорида натрия может удовлетворить потребности галофильного роста вибрионов;Сахароза как ферментируемый источник углерода;Цитрат натрия, щелочная среда с высоким pH и тиосульфат натрия подавляют рост кишечных бактерий.Порошок коровьей желчи и тиосульфат натрия преимущественно подавляют рост грамположительных бактерий.Кроме того, тиосульфат натрия также является источником серы.В присутствии цитрата железа сероводород могут обнаружить бактерии.Если есть бактерии, продуцирующие сероводород, на пластине образуется черный осадок;Индикаторами среды TCBS являются бромкрезоловый синий и тимоловый синий, которые являются кислотно-основными индикаторами.Бромкрезоловый синий – кислотно-щелочной индикатор с диапазоном изменения pH от 3,8 (желтый) до 5,4 (сине-зеленый).Существует два диапазона изменения цвета: (1) кислотный диапазон составляет pH 1,2–2,8, меняющийся от желтого до красного;(2) Диапазон щелочи составляет pH 8,0–9,6, меняющийся от желтого до синего.
Сырно-соевый пептонный агар TSA:
Состав TSA аналогичен составу питательного агара.В национальном стандарте его обычно используют для проверки осевших бактерий в чистых помещениях (помещениях) фармацевтической промышленности.Выберите контрольную точку в тестируемой зоне, откройте пластину TSA и поместите ее в контрольную точку.Пробы следует отбирать при воздействии воздуха в течение более 30 минут в разное время, а затем культивировать для подсчета колоний.Различные уровни чистоты требуют разного количества колоний.
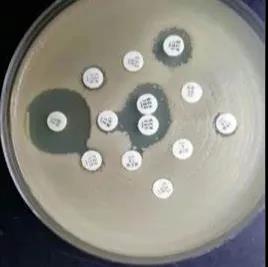
Агар Мюллера-Хинтона:
Среда МН – микробная среда, используемая для выявления устойчивости микроорганизмов к антибиотикам.Это неселективная среда, на которой может расти большинство микроорганизмов.Кроме того, крахмал в ингредиентах способен поглощать токсины, выделяемые бактериями, поэтому не влияет на результаты действия антибиотиков.Состав среды MH относительно рыхлый, что способствует диффузии антибиотиков, поэтому может проявляться очевидная зона задержки роста.В сфере здравоохранения Китая среда MH также используется для тестирования чувствительности к лекарствам.При проведении теста на чувствительность к лекарственным средствам для некоторых особых бактерий, таких как Streptococcus pneumoniae, в среду можно добавлять 5% овечьей крови и НАД для удовлетворения различных потребностей в питательных веществах.
СС-агар:
Агар SS обычно используется для селективного выделения и культивирования сальмонелл и шигелл.Угнетает грамположительные бактерии, большинство колиформ и протея, но не влияет на рост сальмонелл;Тиосульфат натрия и цитрат железа используются для обнаружения образования сероводорода, что делает центр колонии черным;Нейтральный красный цвет является индикатором pH.Колония сбраживающего сахара, продуцирующая кислоту, имеет красный цвет, а колония небродящего сахара — бесцветную.Сальмонеллы представляют собой бесцветные и прозрачные колонии с черным центром или без него, а шигеллы — бесцветные и прозрачные колонии.
Время публикации: 04 января 2023 г.